碳以金刚石、石墨等多种晶态元素碳的形式存在,因此金刚石和石墨实际上是碳的一种,碳元素具有可燃性,稳定性稳定,常温下载稳定的化学性质、点火或高温条件下可发生化学反应,本篇文章就主要研究金刚石和石墨的组成。
如果有两种不同的矿物相互描述,其中一种会被破坏。有一种矿物可以划伤所有其他矿物,但没有矿物可以划伤它,它指的就是钻石。

直到18世纪下半叶,科学家才对构成钻石的“材料”有了清晰的认识。正如前面所提到的,第一世纪的文献中有记录金刚的记录,但是,在1600多年后,钻石的成本从未被知道。
直到18世纪70年代和90年代,法国化学家拉瓦锡(1743-1794)和其他人在氧气中燃烧钻石的实验才发现二氧化碳气体是一种结合了氧和碳的物质。这里的碳是出自金刚石的来源。最后,这些实验证明了金刚石的材料就是碳。
知道钻石的组成是碳仍然不能解释为什么钻石具有如此大的硬度。例如,用来制作铅笔芯的材料是石墨,石墨也由碳制成。然而,石墨是一种比人指甲更柔软的矿物。为什么钻石和石墨这两种矿物如此不同?
这个问题直到1913年才由英国物理学家威廉·布拉格和他的儿子回答。布拉格和父亲用X射线观察金刚石晶体中原子的排列。他们发现,在钻石晶体中,每个碳原子与周围的四个碳原子紧密结合,形成了致密的三维结构。这是在其他矿物中未观察到的特殊结构。此外,这种致密结构使金刚石的密度约为每立方厘米3.5克,约为石墨密度的1.5倍。正是这种致密的结构使金刚石具有最大的硬度。换句话说,钻石是一种通过挤压碳原子而形成的矿物。
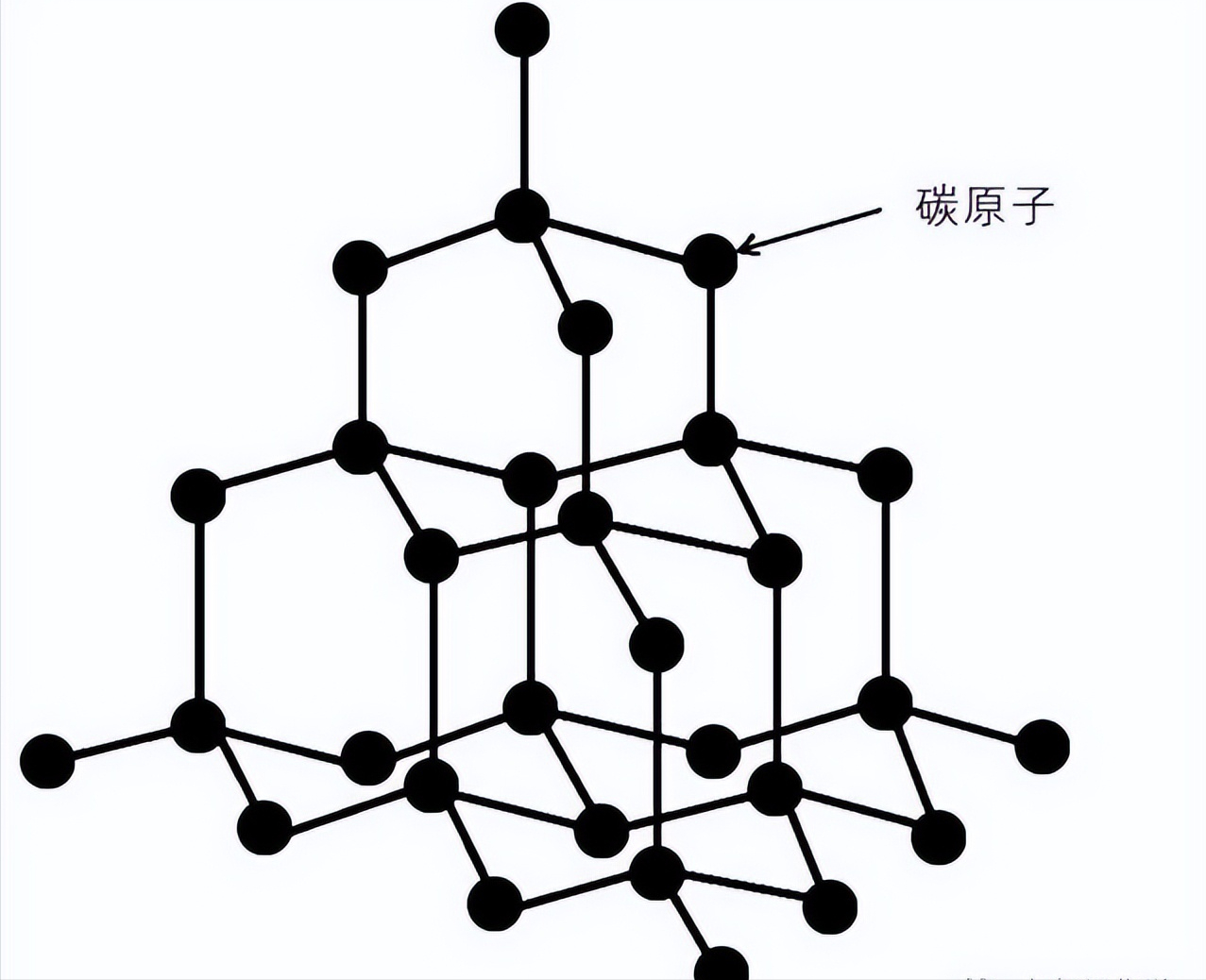
碳是一种非常常见的元素,广泛存在于大气和地壳中。碳已经被人们认识和利用了很长时间,系列碳、有机物的化合物是生命的基础。碳是生铁、锻铁和钢的组成部分之一。碳能在化学上自结合形成大量化合物,这些化合物在生物学和商业上都很重要。生物体中的大多数分子都含有碳元素。
在室温下,元素碳的化学性质相对稳定,不溶于水、稀酸等。
稀碱和有机溶剂;高温和氧气反应产生二氧化碳或一氧化碳;只有卤素中的氟才能直接与元素碳反应;在加热下,元素碳更容易被酸氧化;在高温下,碳可与多种金属反应生成金属碳化物。碳是可以还原的,可用于在高温下熔炼金属。此外,最近研究发现,石墨可以被氯磺酸溶解,形成单层石墨烯氯磺酸“溶液”。

石墨是碳质元素的结晶矿物。其晶格为六角形层状结构。每个网络层之间的距离是340μm,并且同一网络层中的碳原子之间的距离是142μm。属于完全层状解理的六角形体系。分子键是溶液的主要表面,对分子的吸引力较小,自然漂浮性很好。
石墨由于其自身的特殊结构,从而具有以下的特殊性质:

(1)耐高温性:石墨的熔点为3850±50℃,沸点为4250℃,即使经超高温电弧灼烧,重量的损失很小,热膨胀系数也很小。石墨强度随温度的提高而增强,在2000℃时,石墨的强度可以比原来提高一倍。
(2)导电、导热性:石墨的导电性比一般非金属矿物高一百倍左右。导热性超过钢、铁、铅等金属材料。导热系数随温度升高而降低,甚至在极高的温度下,石墨成绝热体。石墨能够导电是因为石墨中的每个碳原子与其他碳原子只形成3个共价键,每个碳原子仍然保留1个自由电子来传输电荷。